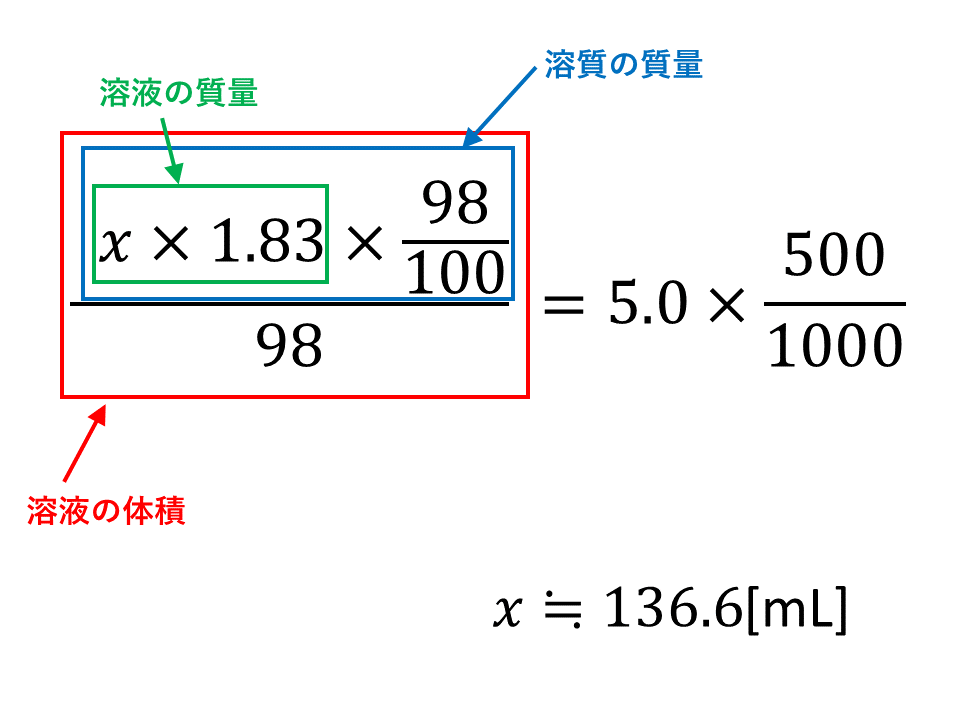
質量パーセント濃度98%、密度184g/cm 3 の濃硫酸(分子量98)のモル濃度を求めよ。 とりあえず密度と分子量を使って計算式を立てる。 基本これを計算すれば終了だが、今回は 質量パーセント濃度の記載があるのでそれを掛ける。 1:モル濃度とは?質量パーセントとの違いもわかる! 2:モル濃度の計算方法・求め方(公式)と単位 3:モル濃度から質量パーセントへの変換方法 4:応用モル濃度と質量パーセントを使った計算問題 質量パーセント濃度を求めるには、公式にあてはめれば一瞬。 質量パーセント濃度は 15% でした。 食塩水が100gあれば、その中に15gの食塩が溶けているくらいの濃さ、ってことです。

Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook
公式 質量 パーセント 濃度 求め 方
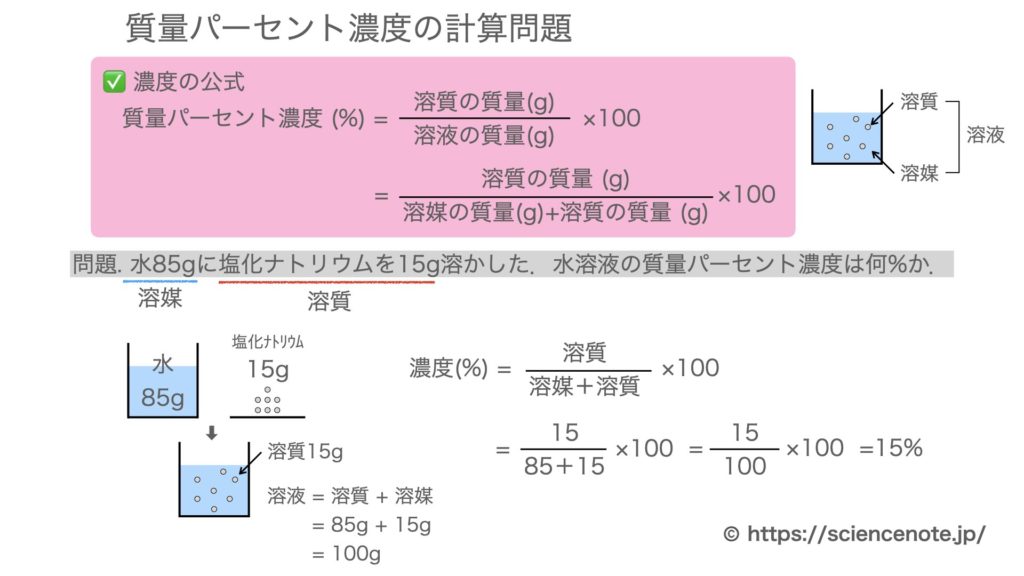
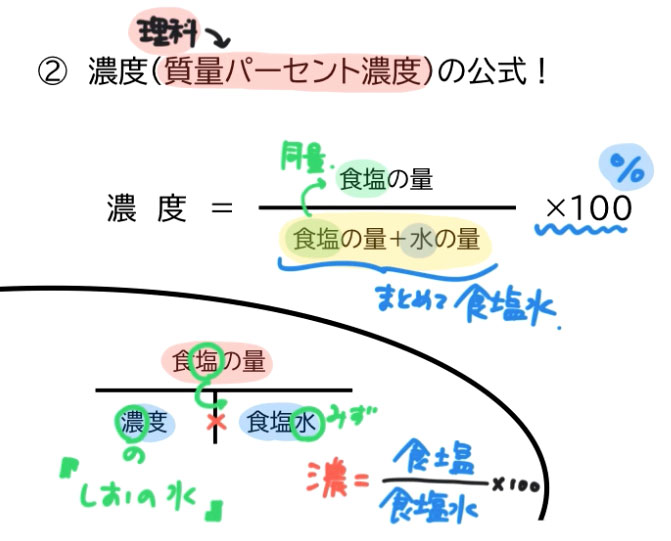
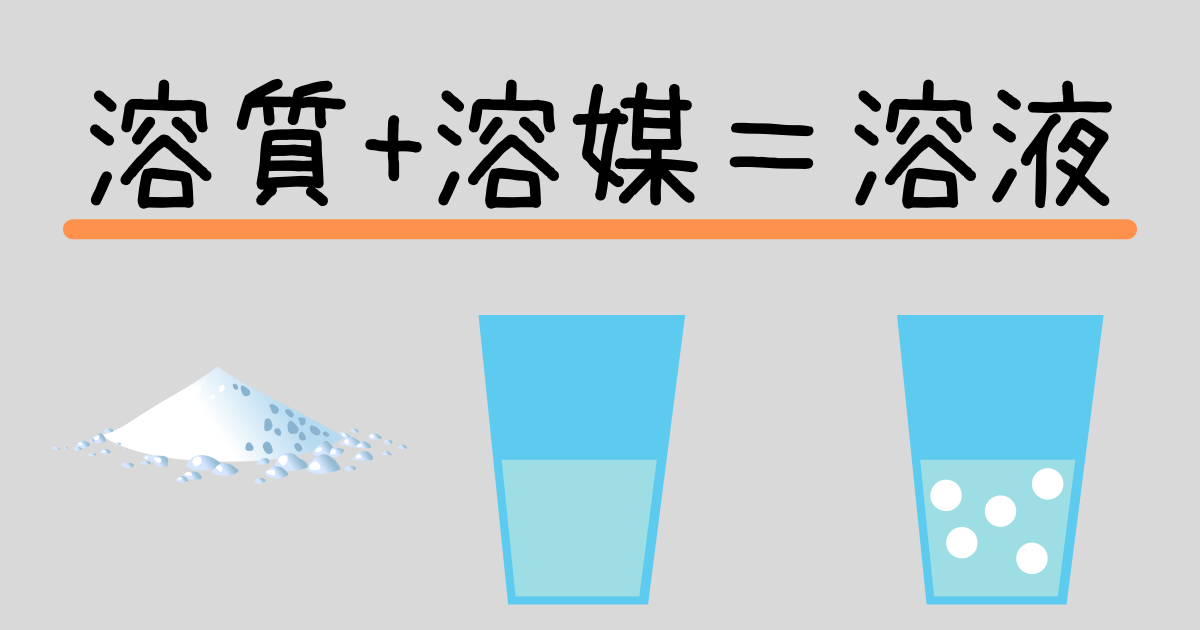
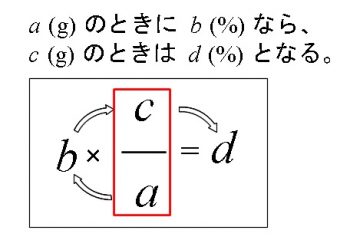
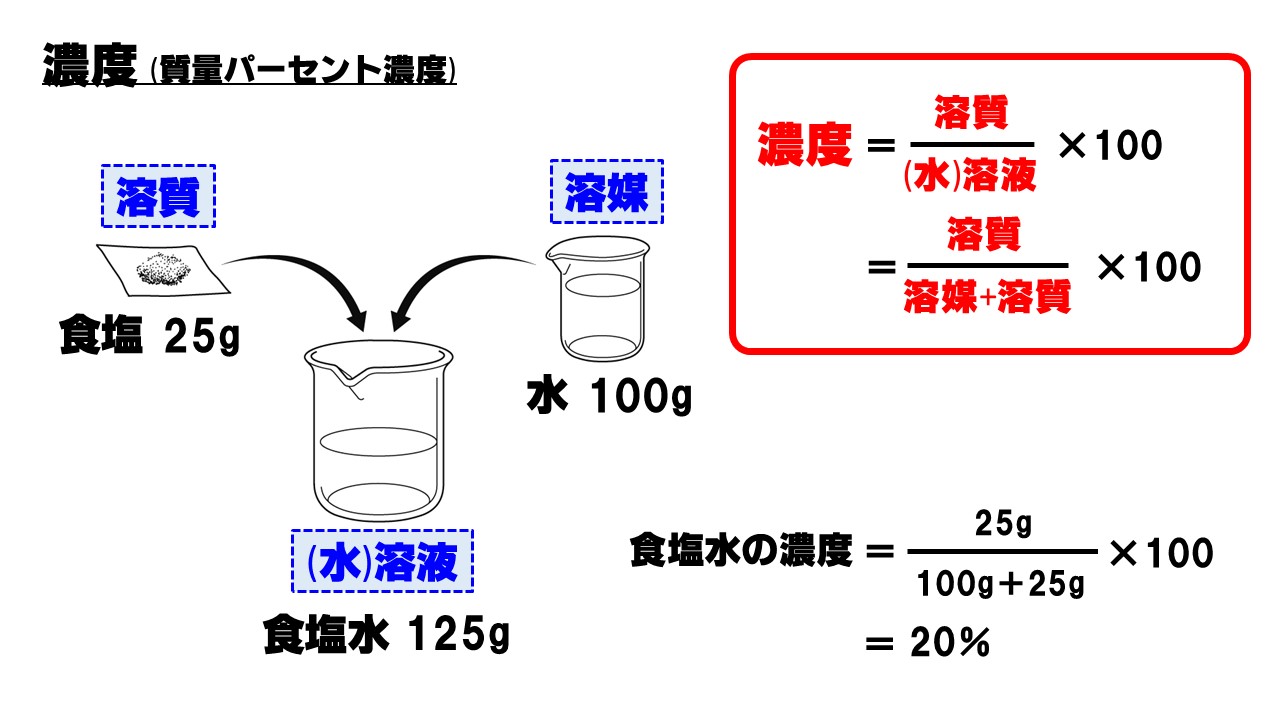
公式 質量 パーセント 濃度 求め 方-質量パーセント濃度 公式 質量パーセント濃度の公式 質量パーセント濃度 = 溶質 (g) 溶液 (g) ×10 公式は以下のようになります。 質量パーセント濃度 % =(溶質 g / 溶液 g)×10 水溶液の濃度(質量パーセント濃度):公式と求め方 水溶液の濃さは溶質の質量を水溶液の質量で割って100をかけて求めます。 溶質の質量÷水溶液の質量×10 質量パーセント濃度 をどの溶液の質量に対する溶質の質量の割合を 百分率で示したもの 求め方 質量パーセント濃度(%) 溶質の質量(g) = × 100 溶液の質量(g) 溶質の質量(g) = × 100 溶質の質量(g)+溶媒



質量パーセント濃度の求め方ってこれであってますか 質量パーセ Yahoo 知恵袋
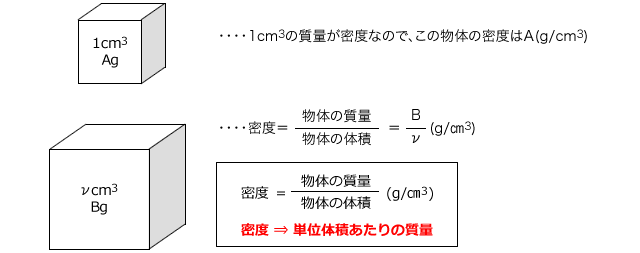
質量パーセント濃度は、 (98÷1840)×100=053% となる。 ※小数第3位を四捨五入した。 質量パーセント濃度からモル濃度への変換も同じことである。 この場合、最初に1lあるとして計算するとよい。 質量モル濃度の考え方 さて、3番目の質量モル濃度は、 質量パーセント濃度(%)=溶質の質量÷溶液の質量×10� エタノールが溶液全体の何wt%であるかを求めるので、 (g)/500 (g)×100= 4 (wt% 濃硫酸1Lの質量は、 1L = 1000cm³ 1000cm³ × 18g/cm³ = 1800g 質量パーセント濃度が98%なので、溶けているH₂SO₄の質量は� 密度の出し方は次の公式で計算できちゃうよ。 密度 = 質量 ÷ 体積
質量パーセント濃度の求め方 *一般的な濃度の計算式です。 質量パーセント濃度 % = 溶質の量 g ÷ 溶液(溶媒+溶質)の量 g × 100 *パーセント(百分率)濃度なので、100倍にします。 つまり、100g(溶液の質量) 中に含まれている溶質の量の割合を 求めることにより濃度がわかります。 *質量水溶液ではなく「水」となっていることに注意してください。 水溶液は水+質量なので、水溶液は=0gです。 40÷0×100= 答え %「溶液の質量パーセント濃度の求め方 と 求め方は公式は実は必要無いのですが、公式化できるので示しておきます。 いくつか例を見ればすぐに違いはわかりま 最近の投稿 21年度共通テスト「化学」の問題と解説(第1問第2問) 21年(令和3年)度共通テスト化学基礎の問題と解説;
質量パーセント濃度とは 次は"質量パーセント濃度"にうつりましょう。 単位:g/g→% $$\frac {溶質の質量 (g)} {溶液の質量 (g)}\times 100=\%$$ これも非常に単純で、溶液の質量 (g)を分母、溶質の質量 (g)を分子に持って来た上で「割合」を求めます。質量パーセント濃度の単位は%(パーセント)。公式は以下のようになります。 公式は以下のようになります。 質量パーセント濃度 % =(溶質 g / 溶液 g)×100 では、質量パーセント濃度はどうやって求めるのでしょうか? 先ほども言いましたが質量パーセント濃度は「 ある溶液中に溶けている溶質の割合 」です。 つまり、溶質の質量が溶液の質量のどれだけを示すのかを表すものになります。




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ



化学基礎モル濃度の計算問題です 類題3 1 質量パーセント濃度が Yahoo 知恵袋
パーセント濃度は、溶質の質量÷溶液の質量×100です。<数式の挿入> ②で求めた溶質の質量÷①で求めた溶液の質量×100で求められるので、<数式の挿入> 438 ÷ 10 ×100= 365% <数式の挿入> これより、求める質量パーセント濃度は365%となります。こんにちは!この記事を書いてるKenだよ。握りたいね。 中1の理科では、 質量パーセント濃度の求め方の公式 を勉強したよね?? 「公式は覚えられそうだけど、テスト本番で忘れそう・・・濃度を示す指標として 質量パーセント濃度 があります。 これは、溶液100g中に溶質がどれだけ溶けているかを示すものです。 式で表すと、 質量パーセント濃度=溶質÷溶液×100 となります! 後ろに100を掛けているのは、出てきた値を百分率で表したいからです。 なので、出てきた値に必ず%をつけましょう! また、溶液は溶質と溶媒の量はを合わせた量に等しい



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp




中1 理科 質量パーセント濃度の計算 P塾
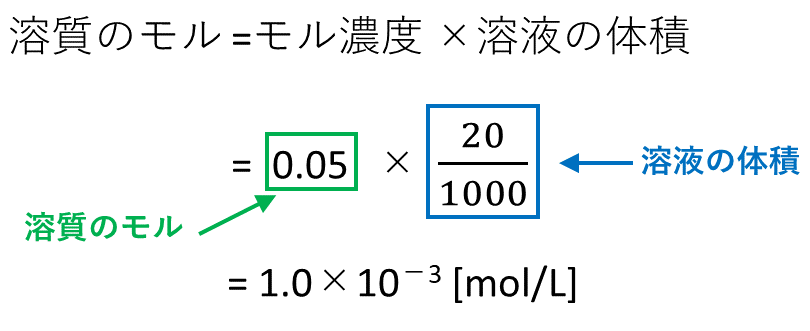
質量パーセント濃度 % 溶質の質量 g 溶液の質量 g 質 量 パ ー セ ン ト 濃 度 % = 溶 質 の 質 量 g 溶 液 の 質 量 g × 100モル濃度(mol/L) = 溶質の物質量(mol)÷ 溶液の体積(L)なので、01 (mol) ÷ 05 (L) 答えは 02mol/L となります。 3質量パーセント濃度とモル濃度の換算 3分でわかる!質量パーセント濃度の求め方の計算公式 Qikeru 求め方は以下の通りです。 質量パーセント濃度と式の形は似ていますが、 大きな違いはやはり100倍しないことですね。 というのも、 単位が%ではないので100倍する必要が無いのです。 なので質量パーセント濃度と異なり、値がほとんど0のような小数になります。 他にも異なる点を




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ
したがって,その濃度は → 24+3x=45 → x=7(%)・・・(答) となります. もし,未知数が初めのどちらかの食塩水の重さなら,分母にxがきますが,分母を払えば平気です.中2なんですけど、 質量パーセント濃度の求め方が全然分かりません。 砂糖10g を 90gの水に溶かしたときの濃度。 よろしくお願いします!! モル濃度とは、溶質のモル (mol)/溶液の体積 (L)で表される、入試必出の知識です。 本記事では、溶液、溶媒、溶質の違い、モル濃度と密度、質量パーセント濃度の違い、公式、求め方、関係性について、図と入試頻出の練習問題でわかりやすく解説します
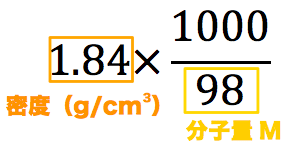



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




117g 500cm3 Dfrac O 3 1 Descubre Como Resolverlo En Qanda
質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 だ。 もうちょっと簡単に言ってあげると、 「溶かす物質の重さ」を「溶けてできた液体の重さ」で割って「100」をかければいいんだ。3表は,物質の密度を示したものである。質量パーセント濃度16%の塩酸450gには、72gの塩化水素が溶けていることが分かります。 方程式を使う解き方 今回求めたいのは 「加える水の 質量パーセント濃度 公式 覚え方 質量パーセント濃度を計算する問題を出してほしい! ・mol濃度⇄質量パーセント濃度⇄質量モル濃度の相互変換や、 ・密度との関係を理解して、 "自由自在にあやつれる"ようにするために大切な、「単位」の考え方まで紹介しています。 具体例(解説・練習用問題付き) 目次(タップした所へ飛びます) 濃度は単位に注目せよ!~3種類を攻



Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ




50g 50g 0 24 Descubre Como Resolverlo En Qanda
2濃度の単位と求め方 21質量百分率濃度(%) 22モル濃度( mol / L ) 23質量パーセント pHの求め方 02Mの酢酸150mlと01MのNaOH100mlを混合した溶液のpHはいくらか?酢酸の解離定数を18×(10のマイナス5乗)、log18=026とする。まず、KaからpKaを求め、次にHendersonHasselbalchの式お応用せよ。という問題質量パーセント濃度 をどのように求めるかというと、次の式に当てはめます。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/溶液の質量〔g〕)×100動画一覧や問題のプリントアウトはこちらをご利用ください。ホームページ → http//19chtv/ Twitter→ https//twittercom/haichi_toaru



質量パーセント濃度 簡単な公式で覚えよう おときち副塾長 電脳空間学習塾かもん Youtube




質量パーセント濃度の計算です この4問がわからないので 教えて欲しいです Clear
W/v% は,質量体積パーセント濃度,若しくは質量容積パーセント濃度といい,分子が溶質 溶質の質量の質量g で分母が溶液の体積mL の場合であり,w/v% =×100 で表す。溶液の体積質量パーセント濃度 公式 覚え方 質量パーセント濃度を計算する問題を出してほしい!☆濃度(質量パーセント濃度)・・・ 小学校で学習した百分率(パーセント)の求め方と同じである。 この内容の授業中に、例えとして「客席100人中50人お客さんが 入っているとき、座席は何%うまっているか?」という質問に対し、 すぐに"50%"と




4番教えてください 計算の仕方がわからないです Clear




質量パーセント濃度の求め方 問題を使ってかんたんに解説するぞ 中学数学 理科の学習まとめサイト
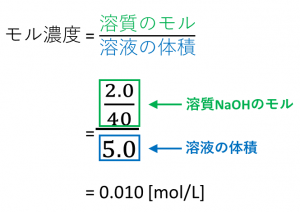
質量パーセント濃度が 22% 、密度が 12g/mL の水酸化ナトリウム水溶液があります。 この水溶液の モル濃度 を求めていきましょう。 さて、どのようにしてモル濃度を求めるか、イメージできますか?モル濃度計算を攻略 公式 希釈時の濃度 密度や質量パーセント濃度と 3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを モル体積とは 化学に関する質問 オンライン家庭教師のnoschool 質量の求め方がわかりません 教え 質量/体積パーセント濃度の場合は、100ml の体積(容積)にはじめに ここでは、溶液の濃度を表す単位である質量パーセント濃度、モル濃度そして質量モル濃度の単位、求め方についてまとめています。 質量パーセント濃度 小学校や中学校で、食塩水の濃度を求めてみましょうという問題を解いたのを記憶しれいる人も多いかと




Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook




ม 1 โน ตของ 理科 中1 質量パーセント濃度 問題 ช น Clear
質量パーセント濃度 計算問題 18 つまり食酢0 溶質(食塩)が10gで、溶媒(水)が90gです。 それでは 「質量パーセント濃度」の求め方について、解説していきますね。 7g を水に溶かし全量を 100g としたとき、 この炭酸水素ナトリウム水溶液は何%溶液と質量/体積(容積)パーセント濃度の求め方 😭 150gの食塩水中に30gの食塩が含まれている。 そのような場合に、「溶液というものは、溶質と溶媒で構成されたものだ」という原理の理解は蔑ろにされがちです。 公式です。 17★質量パーセント濃度の求め方★問題を使ってかんたんに解説するぞ!|中学数学・理科の学習まとめサイト! 質量パーセント濃度の求め方 質量 食塩水の質量パーセント濃度 $$\frac{}{0}\times 100=10%$$ 何gの水を加えればよいか 加える水の量を \(x




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット



溶質を求める




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ



化学講座 第12回 濃度と密度 私立 国公立大学医学部に入ろう ドットコム



1




高校化学 質量モル濃度 映像授業のtry It トライイット




質量 パーセント 濃度 計算 風人



質量パーセント濃度の求め方ってこれであってますか 質量パーセ Yahoo 知恵袋




溶液の濃度 無料で使える中学学習プリント




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット



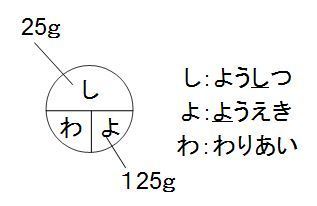
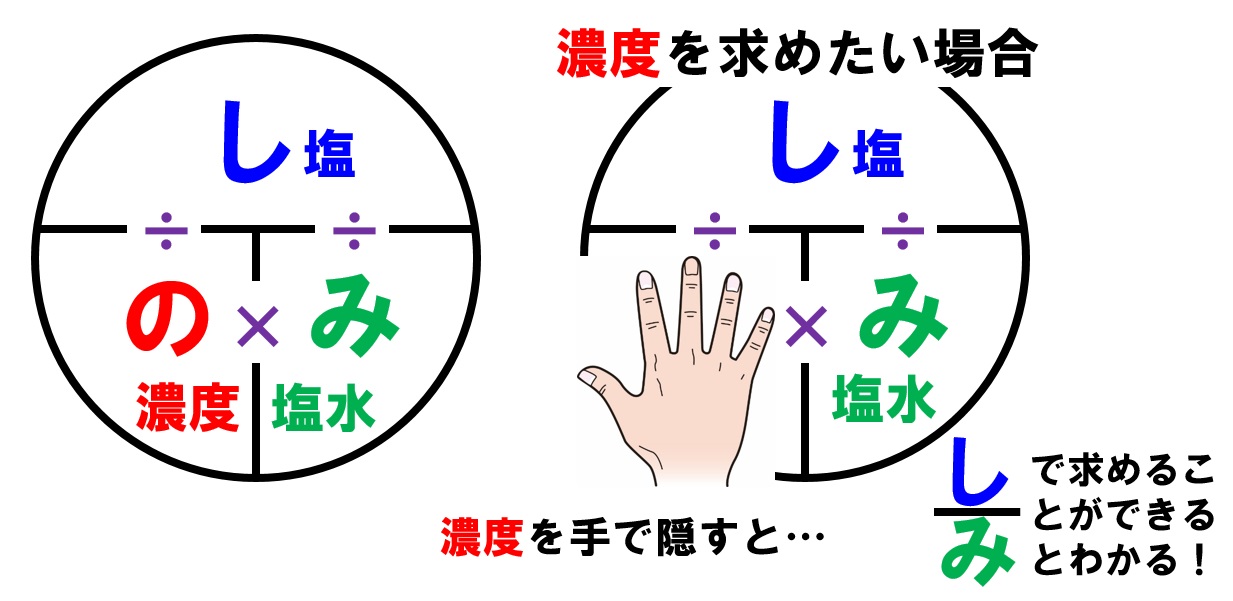
中1理解の 質量パーセント濃度 公式ですが く も わみ Yahoo 知恵袋



1




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




モル 濃度 ピクチャー ニュース




濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン



濃度の応用



しわよ で覚える質量パーセント濃度 中学テスト 入試対策ノート




これで理科マスター 質量パーセント濃度を計算する5つの問題 Qikeru 学びを楽しくわかりやすく




中学理科 計算問題 質量パーセント濃度の計算 Youtube



金魚の薬浴のための0 5 食塩水の作り方 質量パーセント濃度 金魚道楽




4番教えてください 計算の仕方がわからないです Clear




見にくくてすいません 化学の質量パーセント濃度計算で Clear



受験化学 9 溶解度の計算1 みかみの参考書ブログ




高校生物基礎 腎臓のイヌリン濃縮率や原尿量などの計算問題の解き方 高校生物の学び舎



質量 パーセント 濃度 求め 方




質量パーセント濃度の求め方とモル濃度の違い



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu




理科 中1 27 質量パーセント濃度 Youtube




質量パーセント濃度 塾の質問箱
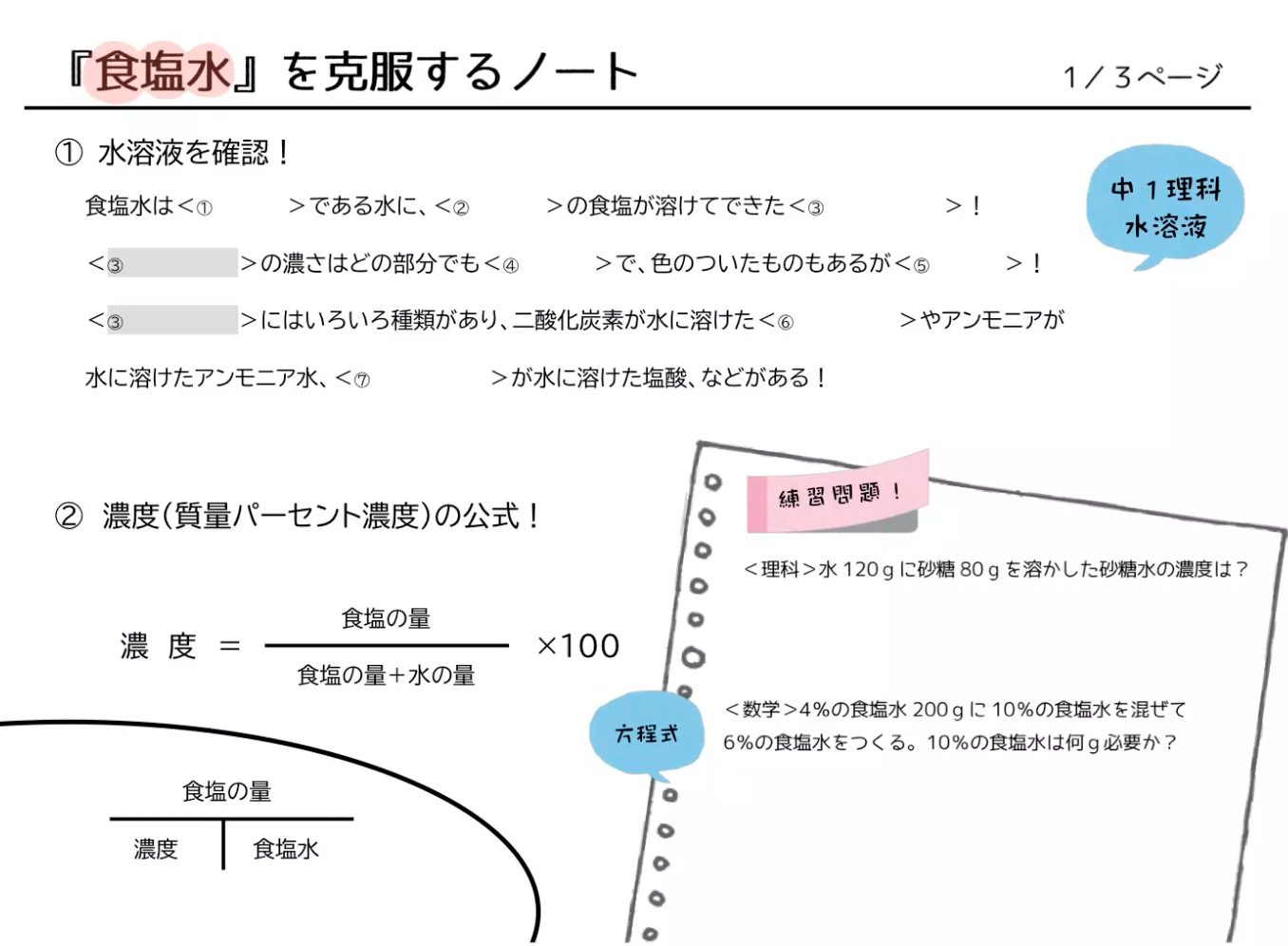



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン
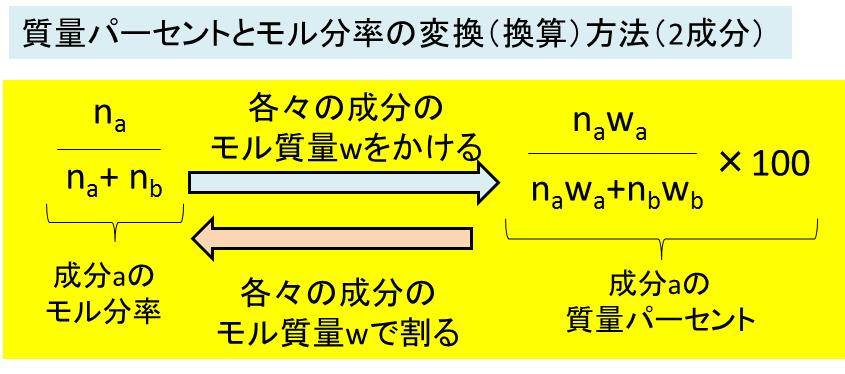



質量パーセントとモル分率の変換 換算 方法 計算




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




濃度について 質量パーセント W W と質量体積パーセント W v 生涯学人 まなびと 楽しいサイエンス 暮らしはサイエンス 子供たち サイエンスを感じて




水 酸化 ナトリウム 分子量 ナトリウム Amp Petmd Com




質量パーセント濃度に関する問題です 0 4がどこから出てきたのかわかりません Clear




モル濃度とパーセント濃度を脳みそを使わず変換する計算法 化学受験テクニック塾
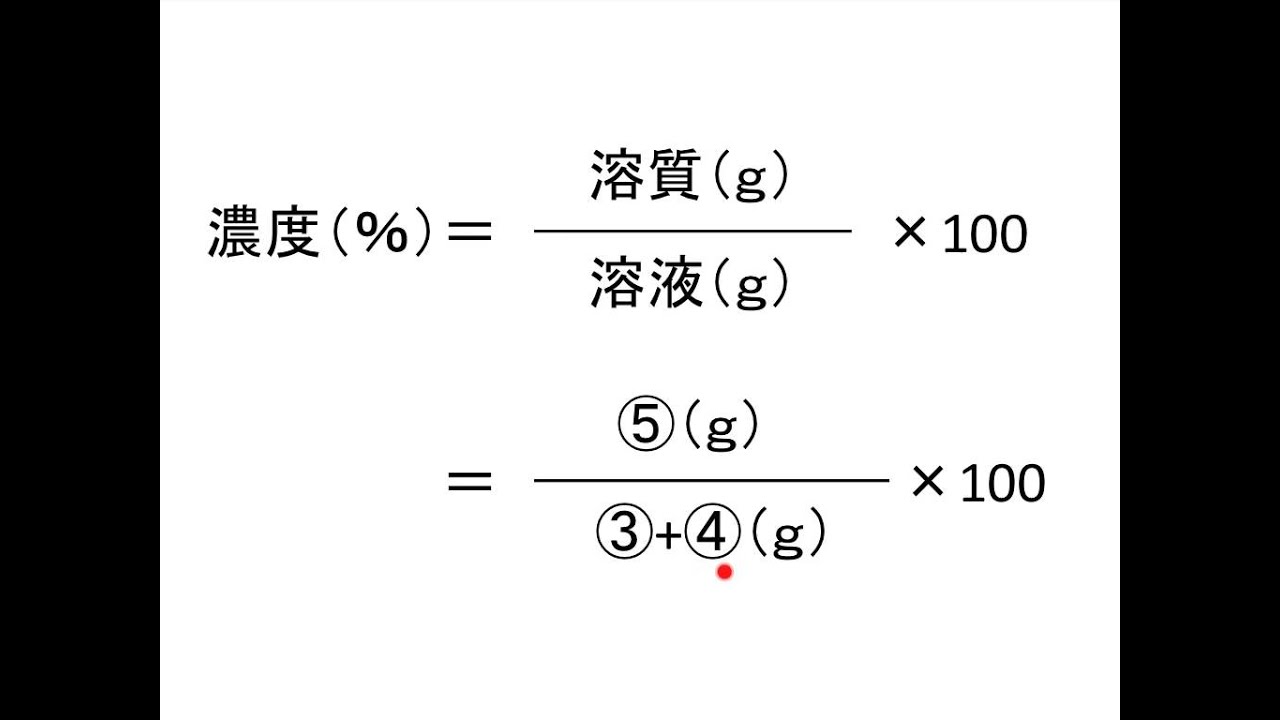



濃度の求め方 絵で覚えよう Youtube




中1 水溶液 中学生 理科のノート Clear




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




質量パーセント濃度 中学生 理科のノート Clear




高校化学基礎 質量パーセント濃度とは 映像授業のtry It トライイット
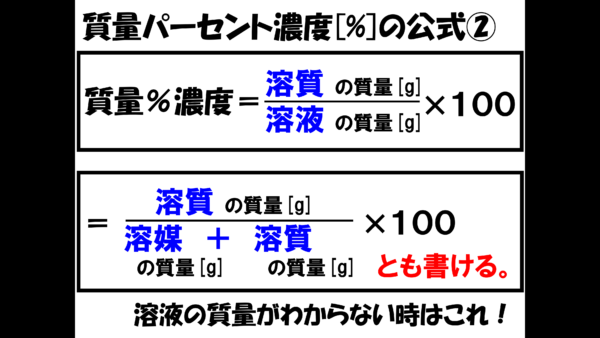



危険物資格取得のための高校化学no 1 濃度計算 F M サイエンスブログ



理科質量パーセント濃度 質量パーセント濃度が の食塩水を Yahoo 知恵袋




高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 ページ 4 4 Study Z ドラゴン桜と学ぶwebマガジン




溶液中の溶質の濃度を示す 質量百分率濃度 を元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン



H30 1 4 4 質量パーセント濃度 On Vimeo



Search Q E6 Ba B6 E8 A3 E5 Ba A6 Tbm Isch




4 6 溶液の濃度 おのれー Note



5分でわかる モル濃度と密度 質量パーセント濃度の考え方を図と練習問題付きで徹底解説 サイエンスストック 高校化学をアニメーションで理解する




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




質量パーセント濃度の計算問題集 応用編 Menon Network




モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




D 100 1 10 01 1 Square Lihat Cara Penyelesaian Di Qanda



水溶液と質量パーセント濃度の計算問題 Sciencenote Jp



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine




質量パーセント濃度に関する問題です までは自力で解解くことができましたが がどう Clear



モル濃度と密度 質量パーセント濃度の考え方 Vicolla Magazine



1




高校化学基礎 密度とモル濃度 映像授業のtry It トライイット




濃度のはなし 中学生向け 質量パーセント濃度について 学習内容解説ブログ




モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ




エレガント質量 パーセント 濃度 最高のぬりえ
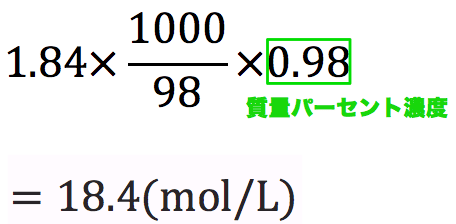



モル濃度計算の解き方 公式 希釈時の濃度 密度や質量パーセント濃度との変換など 化学のグルメ




質量パーセント濃度の計算問題集 基本編 Menon Network




Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




中1理科 水溶液 濃度の計算が10分で理解できる たけのこ塾 勉強が苦手な中学生のやる気をのばす




高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月




4 6 溶液の濃度 おのれー Note




この質量パーセントの計算を 教えてください ずっと考えてたんですけどこの公式の Clear



溶液の質量パーセント濃度の求め方と比重を利用した計算問題




4 6 溶液の濃度 おのれー Note




7 8 9 2が分かりません 教えて下さい Clear



中1理科 濃度 質量パーセント濃度 のポイント Examee



公式を使う




高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




برچسب 質量パーセント濃度 در توییتر




1分でわかる質量パーセント濃度の公式や求め方 基本を登録者数95万人人気講師がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン
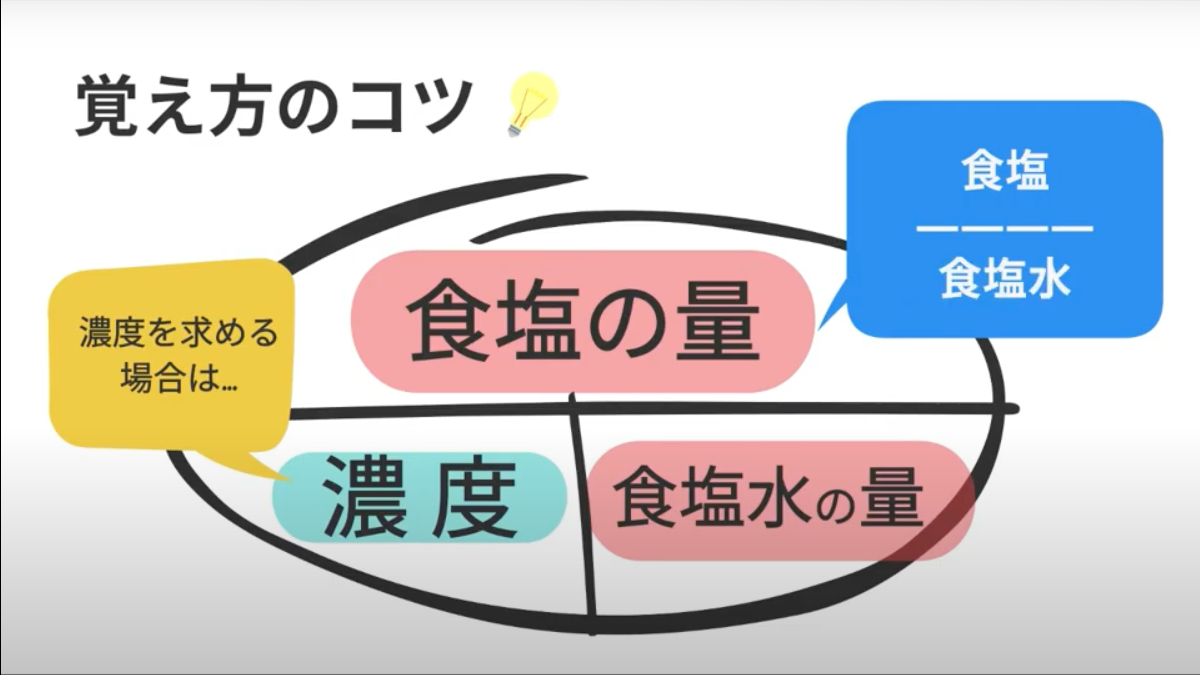



中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン




4 6 溶液の濃度 おのれー Note




中1 理科 中1 32 質量パーセント濃度 Youtube
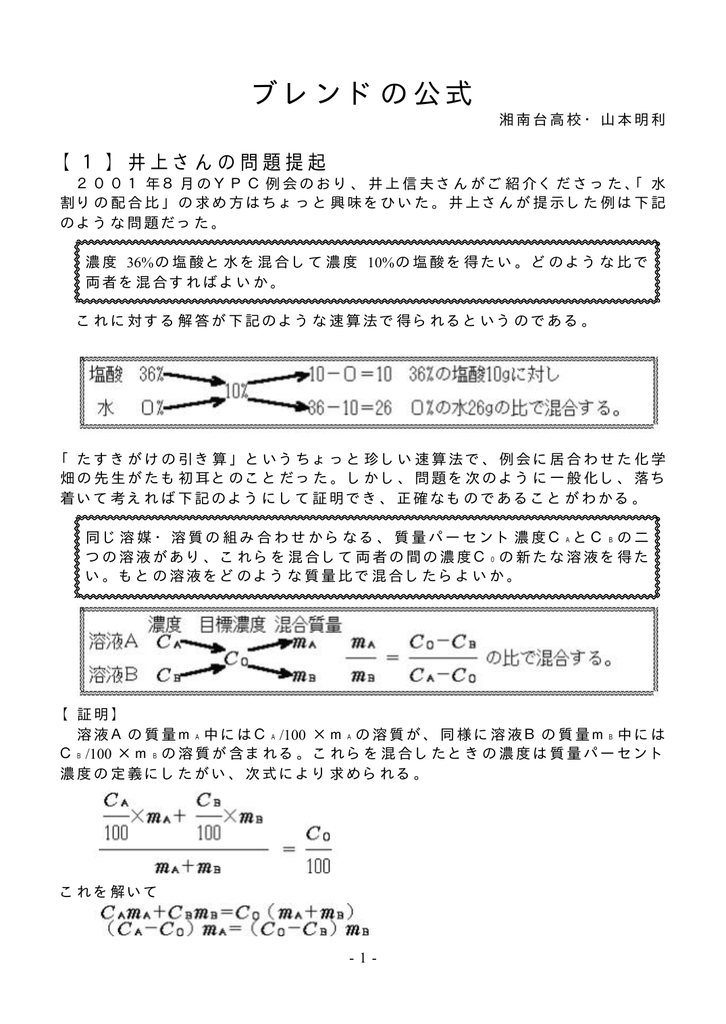



ブレンドの公式 Pdfファイル538kb




3分でわかる 質量パーセント濃度の求め方の計算公式 Qikeru 学びを楽しくわかりやすく




理科の パーセント濃度 の計算問題 教えて欲しいです 出来なくて Clear



0 件のコメント:
コメントを投稿